

美國(guó)食品和藥物管理局(FDA)收到了數(shù)以千計(jì)的關(guān)于其最近提出的規(guī)則的評(píng)論意見(jiàn),該規(guī)則將在體外診斷產(chǎn)品(IVDs)的定義中增加10個(gè)字,從而明確FDA將實(shí)驗(yàn)室開(kāi)發(fā)的測(cè)試(LDTs)作為醫(yī)療器械進(jìn)行監(jiān)管的權(quán)力:"including when the manufacturer of these products is a laboratory--包括實(shí)驗(yàn)室開(kāi)發(fā)的測(cè)試"。該擬議規(guī)則還包括一項(xiàng)長(zhǎng)達(dá)四年的逐步淘汰政策,即在遵守《聯(lián)邦食品、藥品和化妝品法》(FFDCA)的前提下,對(duì)LDTs 取消歷史上賦予的執(zhí)法自由裁量權(quán)。
盡管有人要求延長(zhǎng)征求意見(jiàn)期,但該擬議規(guī)則的征求意見(jiàn)期已于2023年12月4日結(jié)束。在為期三個(gè)月的征求意見(jiàn)期間,食品及藥物管理局收到了6500多條意見(jiàn)。
值得注意的意見(jiàn)包括以下幾點(diǎn):
美國(guó)臨床實(shí)驗(yàn)室協(xié)會(huì)指出,"擬議的規(guī)則將對(duì)患者就醫(yī)、醫(yī)療服務(wù)成本、診斷檢測(cè)的未來(lái)創(chuàng)新以及其他眾多問(wèn)題產(chǎn)生巨大影響",并"引發(fā)重大法律問(wèn)題"。
泛美臨床病毒學(xué)協(xié)會(huì)寫(xiě)道,盡管該協(xié)會(huì) "同意對(duì)LDT的監(jiān)管對(duì)于確保質(zhì)量和患者安全至關(guān)重要",但FDA應(yīng)"考慮該擬議法規(guī)將對(duì)患者和整個(gè)臨床病毒學(xué)領(lǐng)域產(chǎn)生的影響",同時(shí)銘記"該擬議法規(guī)很可能會(huì)導(dǎo)致許多實(shí)驗(yàn)室停止目前提供的傳染病檢測(cè)服務(wù)以及未來(lái)的開(kāi)發(fā),從而嚴(yán)重減少患者獲得準(zhǔn)確及時(shí)的檢測(cè)結(jié)果的機(jī)會(huì)"。
消費(fèi)者保健產(chǎn)品協(xié)會(huì)要求,最終法規(guī)不適用于"屬于一般保健產(chǎn)品的實(shí)驗(yàn)室檢測(cè),這些產(chǎn)品要么被從[《食品、藥品和醫(yī)療器械法》]的器械定義中刪除,要么根據(jù)[美國(guó)食品及藥物管理局器械與放射衛(wèi)生中心]關(guān)于低風(fēng)險(xiǎn)保健產(chǎn)品的一般保健政策而受到執(zhí)法裁量"。
FDA 監(jiān)管 LDTS 的歷史
從歷史上看,F(xiàn)DA并沒(méi)有根據(jù)長(zhǎng)期的執(zhí)法自由裁量權(quán)政策對(duì)大多數(shù)LDT進(jìn)行積極的監(jiān)管,盡管該機(jī)構(gòu)長(zhǎng)期以來(lái)一直認(rèn)為它可以以與商業(yè)IVD相同的方式對(duì)LDT進(jìn)行監(jiān)管。FDA 將LDT定義為根據(jù)1988年《臨床實(shí)驗(yàn)室改進(jìn)修正案》(CLIA)獲得高復(fù)雜性檢測(cè)認(rèn)證的單個(gè)臨床實(shí)驗(yàn)室內(nèi)設(shè)計(jì)、制造和使用的IVD檢測(cè)。FDA對(duì)LDT的執(zhí)法自由裁量權(quán)歷來(lái)不是絕對(duì)的。例如,食品及藥物管理局以前曾對(duì)用于藥物基因組測(cè)試的LDT采取過(guò)執(zhí)法行動(dòng)。值得注意的是,F(xiàn)DA曾試圖對(duì)LDT實(shí)施監(jiān)管制度[1],但并未成功。
在9月29日的新聞稿中,F(xiàn)DA 解釋說(shuō),由于大多數(shù)現(xiàn)代 LDTs 的相關(guān)風(fēng)險(xiǎn)更大,因此正在推進(jìn)擬議規(guī)則。具體來(lái)說(shuō),該局對(duì)某些 LDTs 在合規(guī)性、性能和準(zhǔn)確性方面的不足感到擔(dān)憂。食品及藥物管理局認(rèn)為,由于檢測(cè)結(jié)果不準(zhǔn)確,"患者可能會(huì)開(kāi)始不必要的治療,或推遲或完全放棄[原文如此]適當(dāng)?shù)闹委?.....這可能會(huì)造成傷害,包括病情惡化或死亡"。
建議的逐步淘汰政策
認(rèn)識(shí)到監(jiān)管地位的突然改變會(huì)給患者和行業(yè)帶來(lái)負(fù)面影響,F(xiàn)DA 建議逐步取消賦予 LDT 在遵守 FFDCA 方面的執(zhí)法自由裁量權(quán)。有趣的是,擬議的逐步淘汰政策適用于:(1)符合 FDA 傳統(tǒng)意義上的 LDT(即在單一實(shí)驗(yàn)室內(nèi)設(shè)計(jì)、制造和使用的 LDT);(2)被宣傳為 LDT 但不符合 FDA 傳統(tǒng)定義的 IVD。
因此,擬議的逐步淘汰政策為那些正在銷(xiāo)售后一類(lèi)檢測(cè)項(xiàng)目的實(shí)體提供了額外的執(zhí)法自由裁量權(quán),使其在最長(zhǎng)四年的時(shí)間內(nèi)符合 FFDCA 的規(guī)定。
食品及藥物管理局的意圖是,在長(zhǎng)達(dá)四年的逐步淘汰期之后,LDTs(或那些被作為 LDTs 推廣但不符合食品及藥物管理局傳統(tǒng)定義的 LDTs)將與 IVDs 一樣達(dá)到食品及藥物管理局的要求。
逐步淘汰政策的五個(gè)關(guān)鍵階段將在最終規(guī)則的序言中公布之日起生效,具體如下:
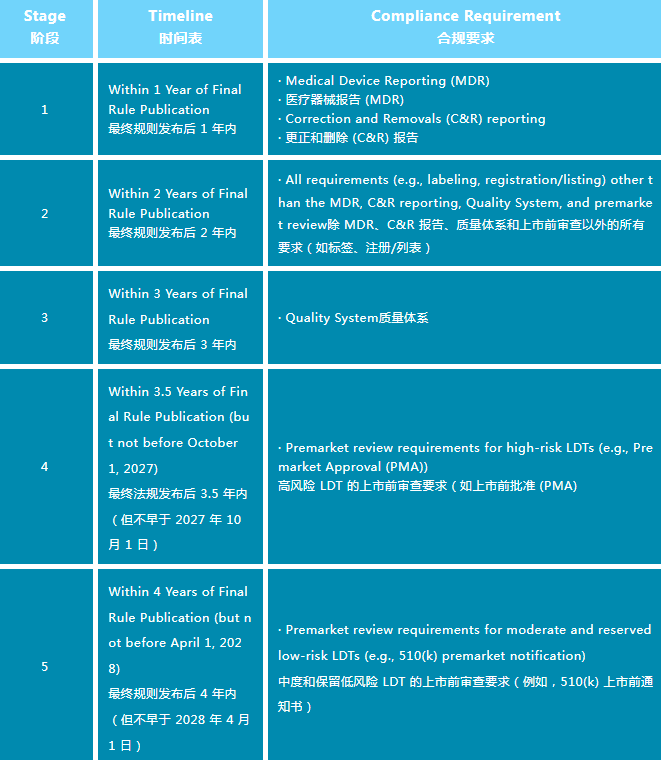
不受擬政策影響的 LDT
某些已被排除在 FDA 執(zhí)法自由裁量權(quán)之外的 LDT 不在這項(xiàng)逐步淘汰政策的范圍之內(nèi),預(yù)計(jì)將繼續(xù)遵守 FFDCA 及其實(shí)施條例。這些 LDT 包括:
作為獻(xiàn)血者篩查或傳染病檢測(cè)所需的人體細(xì)胞、組織以及細(xì)胞和組織基產(chǎn)品(HCT/Ps)獻(xiàn)血者篩查的檢測(cè);
根據(jù) FFDCA 第 564 節(jié)宣布的緊急情況、潛在緊急情況或重大威脅而進(jìn)行的檢測(cè)(例如,通過(guò)緊急使用授權(quán) (EUA) 授權(quán));
以及直接面向消費(fèi)者的測(cè)試。
食品及藥物管理局還將繼續(xù)
對(duì)以下情況行使執(zhí)法裁量權(quán)
具有 1976 年提供的 LDT 中常見(jiàn)的某些特征的 LDT;
人類(lèi)白細(xì)胞抗原(HLA)檢測(cè)試劑盒,其設(shè)計(jì)、制造和使用均在一個(gè)獲得 CLIA 認(rèn)證的實(shí)驗(yàn)室內(nèi)進(jìn)行,該實(shí)驗(yàn)室為移植、HLA 抗體篩查和監(jiān)測(cè)或?yàn)檎鎸?shí)和 "虛擬 "HLA 交叉配型檢測(cè)目的進(jìn)行高復(fù)雜性組織相容性檢測(cè);
僅用于執(zhí)法目的的檢測(cè);以及
專(zhuān)門(mén)用于公共衛(wèi)生監(jiān)測(cè)的檢測(cè)。
接下來(lái)的步驟和現(xiàn)在需要考慮的行動(dòng)
盡管征求意見(jiàn)的時(shí)間相對(duì)較短,但考慮到擬議規(guī)則對(duì)診斷檢測(cè)行業(yè)的潛在影響,我們對(duì)收到的意見(jiàn)數(shù)量并不感到驚訝。我們認(rèn)為,食品與藥物管理局將迅速處理這些意見(jiàn),爭(zhēng)取在 2024 年大選可能導(dǎo)致總統(tǒng)換屆之前公布最終規(guī)則。
我們預(yù)計(jì),最終規(guī)則最終將由法院提起訴訟,考慮到該機(jī)構(gòu)在公布擬議規(guī)則時(shí)就擬議規(guī)則起草了廣泛的討論和理由,看來(lái)食品與藥物管理局也是如此。
此外,隨著 FDA 再次努力直接根據(jù)其現(xiàn)行的 FFDCA 對(duì) LDT 進(jìn)行監(jiān)管,這有可能促使美國(guó)國(guó)會(huì)通過(guò)《驗(yàn)證準(zhǔn)確、領(lǐng)先的 IVCT 開(kāi)發(fā)(VALID)法案》。VALID 法案在上屆國(guó)會(huì)以微弱劣勢(shì)未獲通過(guò),在本屆國(guó)會(huì)的頭幾個(gè)月中又被提出,國(guó)會(huì)山可能會(huì)重新對(duì)通過(guò) VALID 法案產(chǎn)生興趣。VALID 法案將建立一個(gè)專(zhuān)門(mén)針對(duì) IVD 的 FDA 監(jiān)管框架,與 FFDCA 下的 FDA 權(quán)力相比,該框架可能會(huì)減輕監(jiān)管負(fù)擔(dān)。
盡管我們可能還有很多年才會(huì)對(duì) LDT 實(shí)施積極的監(jiān)管,但我們建議實(shí)驗(yàn)室(或推廣 LDT 的實(shí)驗(yàn)室)開(kāi)始整理他們的 LDT 產(chǎn)品組合,并進(jìn)行監(jiān)管調(diào)查,以確定根據(jù)目前 FDA 的產(chǎn)品分類(lèi)將產(chǎn)品推向市場(chǎng)的潛在途徑。
了解監(jiān)管途徑和上市前申報(bào)中可能需要包含的相關(guān)檢測(cè),有助于實(shí)驗(yàn)室在執(zhí)法裁量權(quán)失效后決定要繼續(xù)推廣哪些 LDT。此外,實(shí)驗(yàn)室還可以開(kāi)始考慮維持運(yùn)營(yíng)可能需要哪些資源(資金和人員)。
[1] See FDA Draft Guidance, Framework for Regulatory Oversight of Laboratory Developed Tests (LDTs) (Oct. 3, 2014). The draft guidance was never finalized.
[2] Interestingly, to submit MDRs or report C&Rs the entity will need to have already registered its operations with the FDA. Accordingly, Stage 1 and 2 will likely need to be completed simultaneously.

關(guān)注“廣東技術(shù)性貿(mào)易措施”,獲取更多服務(wù)。
