

歐洲委員會(huì)的醫(yī)療器械協(xié)調(diào)小組(MDCG)正對(duì)醫(yī)療技術(shù)制造商發(fā)出盡快在新的醫(yī)療器械和診斷設(shè)備法規(guī)下獲得認(rèn)證的警告,這可能是對(duì)該行業(yè)迄今為止最強(qiáng)烈的警告。
MDCG此前在2023年11月29日發(fā)布了一份立場(chǎng)文件,其中指出,盡管在幾個(gè)截止日期延長(zhǎng)后,有更多的制造商申請(qǐng)將其產(chǎn)品在新的歐盟醫(yī)療器械法規(guī)(MDR)或體外診斷器械法規(guī)(IVDR)下獲得認(rèn)證,但還不足以充分利用新的時(shí)間表。如果制造商不及時(shí)申請(qǐng),他們的產(chǎn)品有被市場(chǎng)淘汰的風(fēng)險(xiǎn)。截止目前,MDR和IVDR下的產(chǎn)品認(rèn)證數(shù)量依舊沒(méi)有提升,制造商們需要抓緊完成相關(guān)臨床試驗(yàn)以完成認(rèn)證。
MDR認(rèn)證通過(guò)數(shù)量持續(xù)走低
根據(jù)MDCG的數(shù)據(jù),盡管有超過(guò)24,000個(gè)醫(yī)療器械需要從醫(yī)療器械指令(MDD)過(guò)渡到MDR,但制造商只提交了13,000個(gè)設(shè)備的MDR認(rèn)證申請(qǐng),而截至2023年6月,只發(fā)放了3,900個(gè)證書(shū)。而截止2023年12月,由Pure Global旗下GRIP大數(shù)據(jù)平臺(tái)顯示,最近半年來(lái)的通過(guò)MDR注冊(cè)認(rèn)證數(shù)量持續(xù)走低。
此外,根據(jù)MDCG的說(shuō)法,已發(fā)放的約1,000個(gè)設(shè)備證書(shū)與更新有關(guān)。將包含在同一證書(shū)中的設(shè)備轉(zhuǎn)移的趨勢(shì)可能會(huì)妨礙通知機(jī)構(gòu)規(guī)劃和處理能力,該組織補(bǔ)充道。
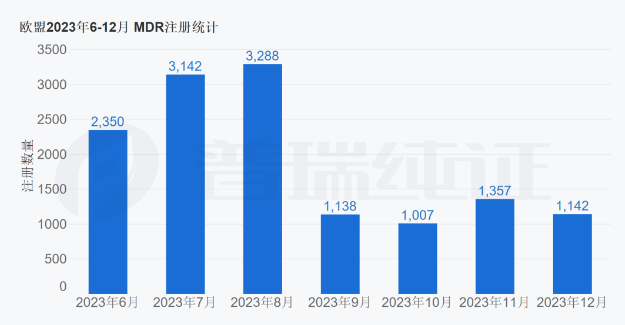
(數(shù)據(jù)來(lái)源:GRIP平臺(tái))
IVDR下參與
符合性評(píng)估的緊迫性
MDCG寫道:“對(duì)于體外診斷器械(IVDs)的情況更加令人擔(dān)憂。在體外診斷醫(yī)療器械指令(IVDD)下,只有大約8%的IVDs需要通知機(jī)構(gòu)參與符合性評(píng)估,而在體外診斷器械法規(guī)(IVDR)下,這個(gè)比例約為80%。”
“盡管如此,與IVDD下發(fā)放的約1,500個(gè)證書(shū)相比(僅占IVDR預(yù)期證書(shū)數(shù)量的一小部分),截至2023年6月,只有1,150份IVDR申請(qǐng)已被提交,發(fā)放的證書(shū)約為500份。”該組織補(bǔ)充道。GRIP大數(shù)據(jù)平臺(tái)顯示,最近半年來(lái)的通過(guò)IVDR注冊(cè)認(rèn)證數(shù)量也是銳減狀態(tài)。
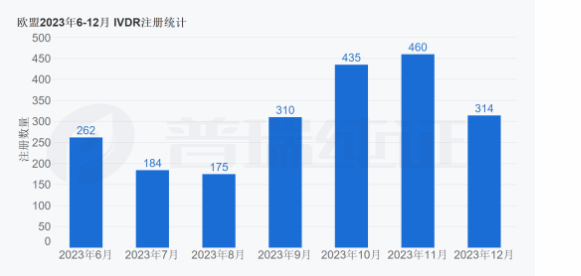
(數(shù)據(jù)來(lái)源:GRIP平臺(tái))
MDCG告訴制造商要記住,與之前的指令相比,符合性評(píng)估流程在新的法規(guī)下需要更長(zhǎng)的時(shí)間。
根據(jù)通知機(jī)構(gòu)的數(shù)據(jù),導(dǎo)致時(shí)間延長(zhǎng)的一個(gè)重要因素是大多數(shù)提交的申請(qǐng)是不完整的。他們一直敦促制造商在年底之前申請(qǐng)認(rèn)證,并確保申請(qǐng)完整且質(zhì)量高。
“考慮到法規(guī)規(guī)定的截止日期,因此敦促制造商加強(qiáng)努力,盡快進(jìn)行過(guò)渡,并不要進(jìn)一步延遲提交,因?yàn)檫@可能導(dǎo)致通知機(jī)構(gòu)工作的瓶頸和市場(chǎng)上可能出現(xiàn)產(chǎn)品短缺。”MDCG寫道。“這對(duì)于D類體外診斷器械的制造商尤為重要,他們必須在2025年5月之前完成向IVDR的過(guò)渡。”(最新消息該日期已延期)

關(guān)注“廣東技術(shù)性貿(mào)易措施”,獲取更多服務(wù)。
