

繼美國食品藥品監(jiān)督管理局(FDA)在2023年8月7日發(fā)布了工廠注冊和產(chǎn)品列名的指南文件征求意見稿后。
9月18日,F(xiàn)DA對后續(xù)工廠注冊和產(chǎn)品列名系統(tǒng)擬收集的信息開啟意見征求,包括系統(tǒng)界面的公開,以及兩類紙質(zhì)提交表格的草稿發(fā)布(FDA 5066表格和FDA 5067表格)。意見征集截至2023年10月18日。
來源:federalregister.gov
其中關(guān)鍵信息如下:
注冊賬號頁面和主頁信息展示
平臺名稱定為Cosmetics Direct,與FDA藥品提交平臺CDER Direct的名稱類似。
界面展示
包括工廠注冊和產(chǎn)品列名的不同入口、相關(guān)的FDA外鏈和賬號管理界面。

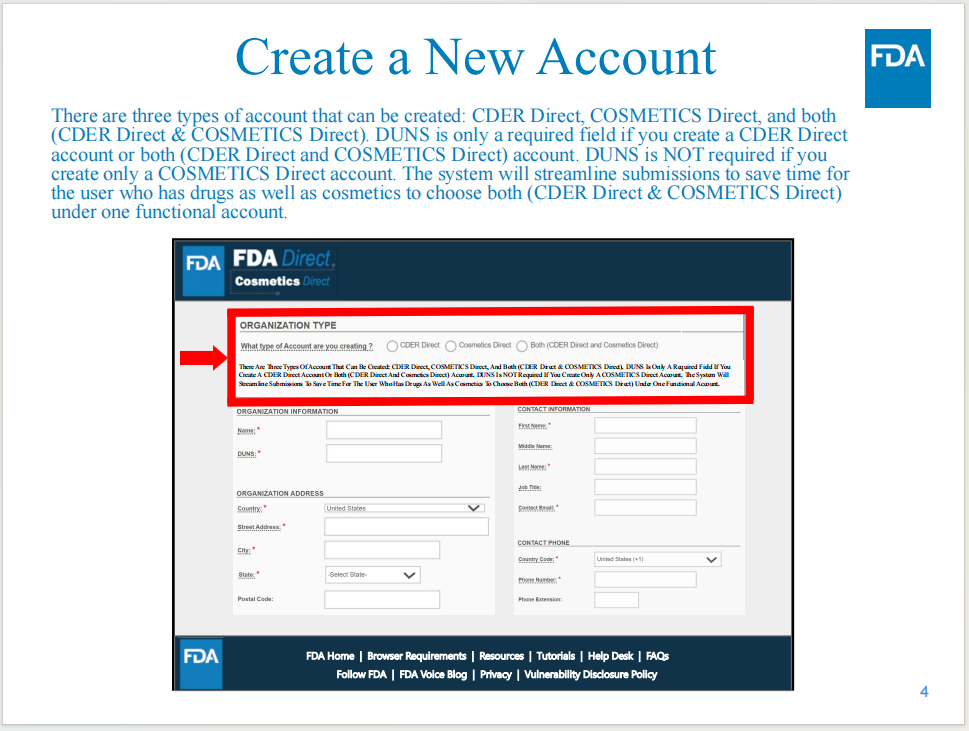
賬號創(chuàng)建
支持同時創(chuàng)建Cosmetics Direct和CDER Direct兩個賬號,但如果僅需要創(chuàng)建Cosmetics Direct賬號,無需提供鄧白氏碼。
賬號創(chuàng)建所需信息包括:機(jī)構(gòu)名稱、鄧白氏碼(部分情況需要)、機(jī)構(gòu)地址信息、聯(lián)系人信息。
產(chǎn)品信息展示
所有完成列名的產(chǎn)品信息都可以在主頁顯示。

工廠注冊操作界面
工廠注冊操作方式,包括在平臺上創(chuàng)建電子表格和上傳SPL文件兩種方式。
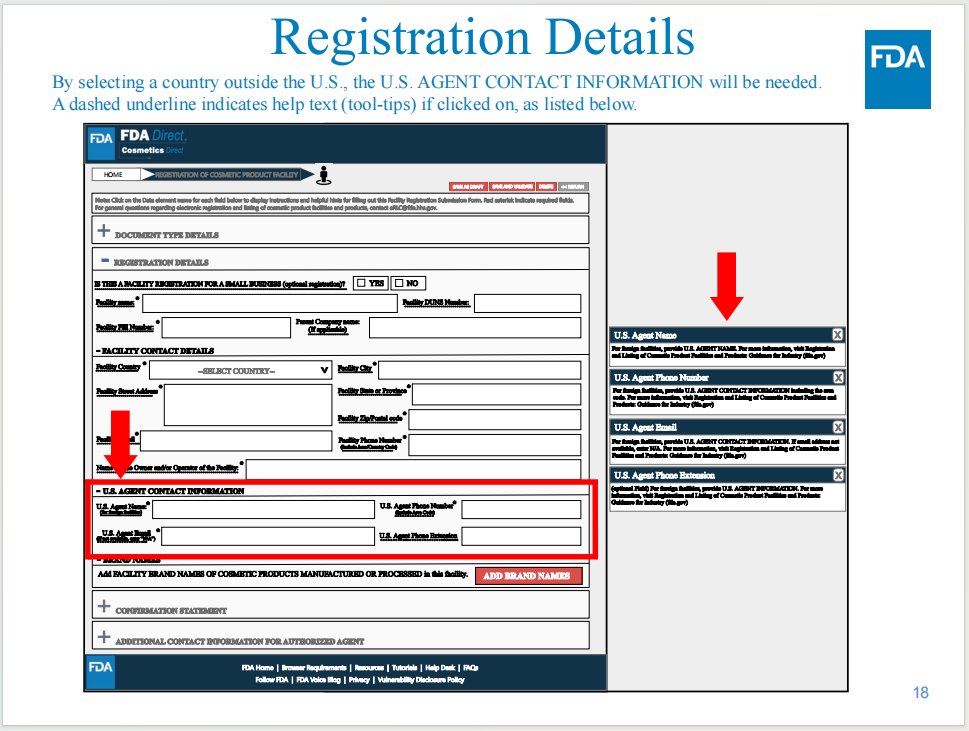
需要填寫美國代理的公司信息和聯(lián)系方式
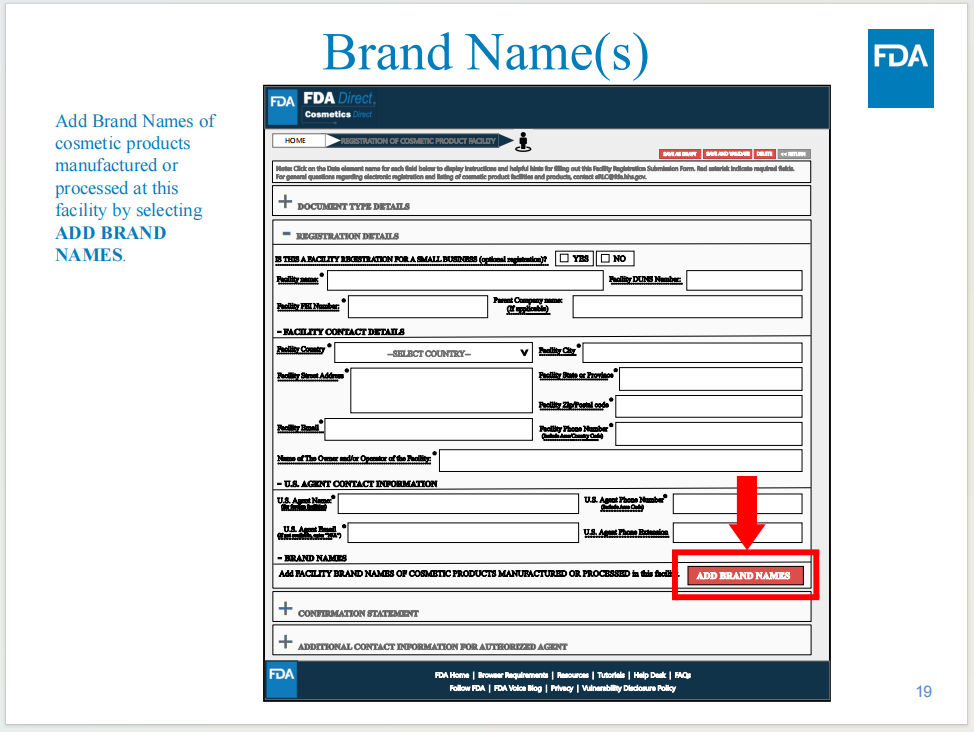
產(chǎn)品信息是否為必填項尚不確定
從目前顯示的界面截圖來看,還無法確定進(jìn)行工廠注冊操作環(huán)節(jié)時相關(guān)產(chǎn)品品牌信息上傳是否為必填項,還有待正式系統(tǒng)上線后驗證。
當(dāng)完成遞交后,會獲得工廠注冊號碼
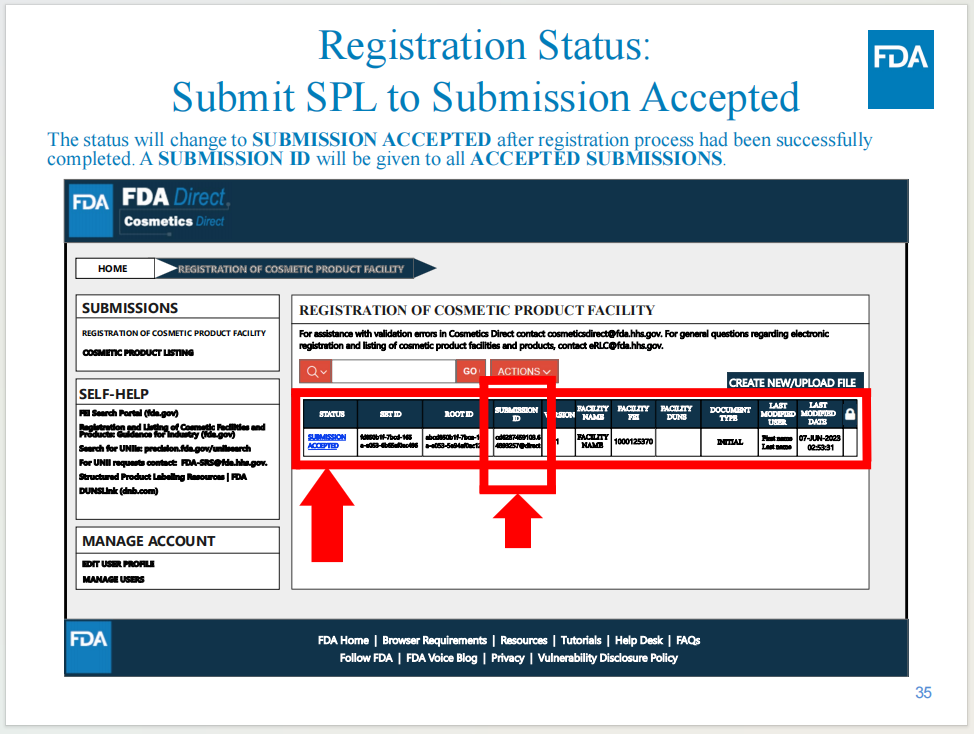
產(chǎn)品列名界面
產(chǎn)品操作方式,包括在平臺上創(chuàng)建電子表格和上傳SPL文件兩種方式。
主要信息填寫
主要需要填寫的信息包括:代理人信息、產(chǎn)品信息、原料信息和工廠信息。

原料信息填寫
原料信息上傳可以通過文件上傳的方式進(jìn)行,但未說明接受的文件格式。
需要填寫的信息包括原料的名稱(需要按照美國的原料命名規(guī)則)以及UNII編號,如我們之前所推測的,并不需要填寫配方的原料使用濃度信息。
*根據(jù)Fair Packaging and Labeling Act,美國的化妝品包裝和標(biāo)簽上的化妝品成分命名需要參考 21CFR701.30 中的要求。

工廠信息填寫
工廠的信息中,對于非小規(guī)模企業(yè),F(xiàn)EI碼是必填信息。

當(dāng)完成遞交后,會獲得產(chǎn)品列名號碼
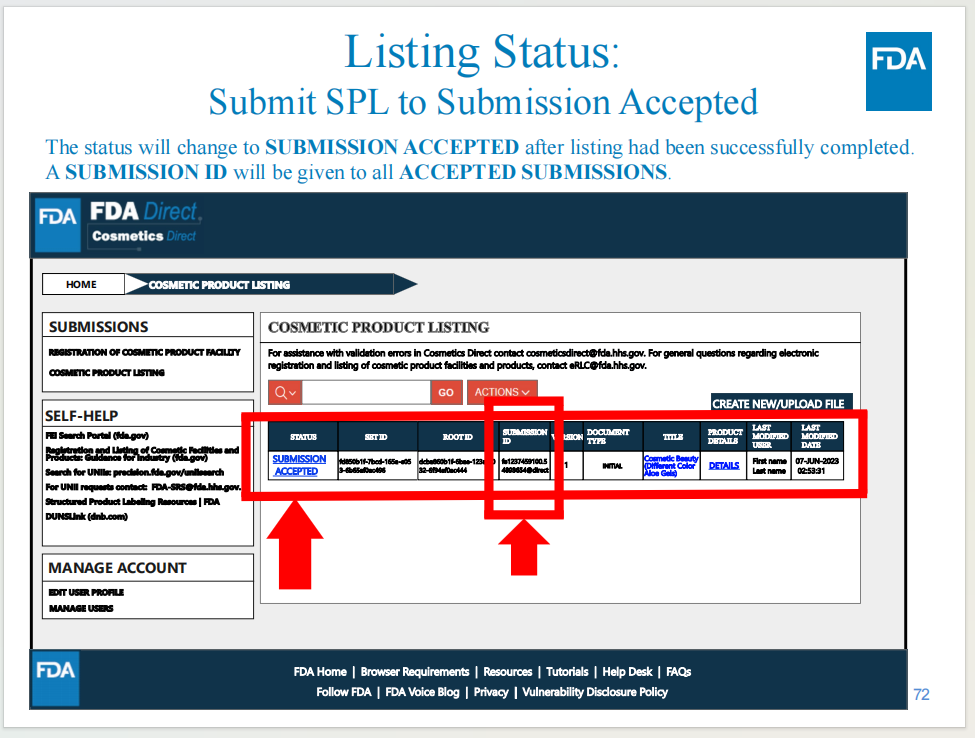
系統(tǒng)意見征詢截至10月18日,妝研猜測系統(tǒng)正式上線的時間可能在10月底或11月初,距今年年底截止期12月29日已經(jīng)非常接近。輸美企業(yè)務(wù)必關(guān)注新系統(tǒng)的相關(guān)內(nèi)容,可以提前為工廠注冊和產(chǎn)品列名做準(zhǔn)備,以免影響產(chǎn)品銷售。
原文鏈接:https://www.reach24h.com/cosmetic/industry-news/mocra-new-system

關(guān)注“廣東技術(shù)性貿(mào)易措施”,獲取更多服務(wù)。
